
伍仟伍佰多字,Eknower仰望答主,脖子已酸。能看完的都是牛人。看不完的看這段話就夠了:電池天生能量密度就不如化石燃料,為了有序的電子轉(zhuǎn)移,為了有序的鋰離子與鋰原子的分布,電池需要電解質(zhì)以及各種輔助材料,需要在陰極陽極表面有規(guī)整的結(jié)構(gòu),而這些都是以能量密度為代價(jià)的。別總罵搞儲(chǔ)能技術(shù)的不行 了,能做到今天這樣已經(jīng)是人類智慧之大成了,以后可能電池表面結(jié)構(gòu)上還會(huì)有大招,以及……這個(gè)以及是啥就不說了,答案在文章結(jié)尾。看到了不要吐血哦。
當(dāng)前電池的能量密度為何難以提高?
一句話的簡單回答是:電池背后的化學(xué)限制了電池的能量密度。
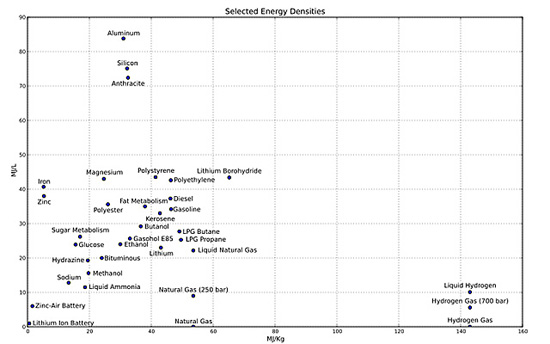
上圖是從wiki中轉(zhuǎn)載的各種能量載體的能量密度。
我們的手機(jī),平板,筆記本,手表,以及赫赫有名的Tesla使用的電池,都是最左下角的鋰離子電池(我怕大家找不到劇透一下)。
然后請(qǐng)尋找汽油,柴油,丁烷,丙烷,天然氣的位置。
估計(jì)找到之后一般人會(huì)有以下想法:
1)電池技術(shù)太弱了;
2)電池技術(shù)大有可為;
3)燃料電池技術(shù)將是明日之星。
我的想法是:以上都是幻覺,幻覺。
為什么?這得先科普下電池的基本原理。我們先做一點(diǎn)知識(shí)性的回顧(或者說普及)。
我們生活中所見到的絕大部分燃料與電池,這類能量載體,涉及到的具體化學(xué)過程千變?nèi)f化,但總能歸納到一個(gè)氧化還原反應(yīng)。
什么是氧化還原?看下圖。
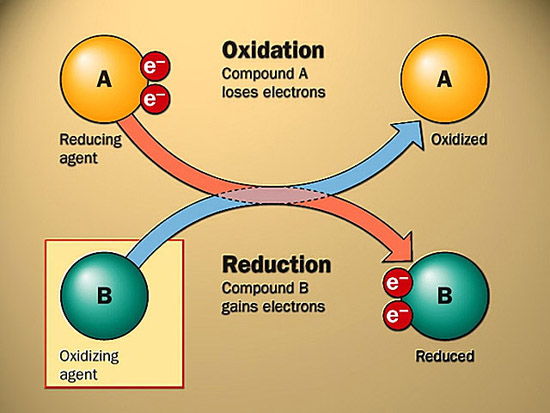
氧化還原反應(yīng)的實(shí)質(zhì)是電子從還原劑到氧化劑的轉(zhuǎn)移。大家有沒覺得跟電池很像?電池的負(fù)極為還原劑,正極為氧化劑(不是特別準(zhǔn)確)。電子從負(fù)極經(jīng)過外部電路流至正極,然后順便做點(diǎn)功:點(diǎn)亮燈泡,驅(qū)動(dòng)車輛,支撐手機(jī)與電腦。
既然電子是能量的來源,那么我們就可以通過電子的密度來估計(jì)能量密度了。這里我們先假設(shè)電子能做的功都是一致的(這個(gè)顯然不對(duì),實(shí)際上取決于氧化劑與還原劑的種類。但如果仔細(xì)考察,對(duì)于常見的電池與燃料,這點(diǎn)不是主要因素)。
能量載體的電子密度,在按體積計(jì)算情況下,主要取決于兩個(gè)因素。
1、能量載體的物質(zhì)密度。固體>液體>>>>>氣體。這點(diǎn)很好理解。
2. 能量載體的電子轉(zhuǎn)移比例。如果化學(xué)忘光了,這點(diǎn)很不好理解;如果還有些印象,這點(diǎn)也很好理解。原子的內(nèi)層電子基本不參與化學(xué)反應(yīng),自然也不會(huì)轉(zhuǎn)移,只有外層那幾個(gè)才會(huì)轉(zhuǎn)移做功。電子轉(zhuǎn)移比例是指參與反應(yīng)的電子數(shù)與分子總電子數(shù)的比例。通常而言,還原劑的外層電子數(shù)不會(huì)太多,但內(nèi)層電子數(shù)可是隨著原子數(shù)增大而增大的。更要緊的是,原子數(shù)增加后質(zhì)子與中子都在增加,而這兩者都是質(zhì)量的主要來源。 舉幾個(gè)例子:
1)H2-2e=2H+ 氫原子只有一個(gè)電子,全參與反應(yīng)了,電子轉(zhuǎn)移比是100%
2)Li-e=Li+ 鋰原子有三個(gè)電子,只有一個(gè)參與反應(yīng),電子轉(zhuǎn)移比是1/3=33%
3)Zn-2e=Zn(2+) 鋅原子有三十個(gè)電子,只有兩個(gè)參與反應(yīng),電子轉(zhuǎn)移比是2/30=6.7%
對(duì)于大多數(shù)物質(zhì),電子轉(zhuǎn)移比例都很低,原因前面提到過。由此可見只有在元素周期表的前兩行的輕原子有可能成為好的能量載體。前兩行元素只有10個(gè),氫氦鋰鈹硼,碳氮氧氟氖。其中氦與氖都是惰性氣體,排除。氧與氟都是氧化劑,排除。氮大多數(shù)情況下都是準(zhǔn)惰性氣體,如果不是惰性氣體要么毒死人要么熏死人,排除。所以我們還剩下5個(gè)元素,氫(100%),碳(66%),硼(60%),鈹(50%),鋰(33%)。
再進(jìn)一步說,如果我們把一個(gè)原子當(dāng)成電池的負(fù)極。那么這個(gè)半電池的能量密度(質(zhì)量單位)可以用電子轉(zhuǎn)移數(shù)與原子量來估算。如此一來,上面的比例將更為懸殊。還以氫作為基準(zhǔn):
碳(4/12 33%) 硼(3/10.8 28%), 鈹(2/9,22%) 鋰(1/7,14%)
大家很容易發(fā)現(xiàn),最適合擔(dān)任能量載體的兩種元素分別是碳和氫,碳?xì)浠衔铮瑢?shí)際上就是我們生活中常見的汽油柴油煤油天然氣等燃料。汽車選擇這些高能量載體作為能量來源,已經(jīng)是自然中的較優(yōu)解了。電池跟各種碳?xì)浠衔锵啾龋梢哉f是天生不足。
除了先天不足,電池還有四大問題,又進(jìn)一步降低了他的能量密度。
一、擺脫不掉的電解液
根據(jù)上面的解釋,我們可以知道,電池很難在能量密度上超過燃料,不過似乎也能達(dá)到燃料的一半到1/4的水平。然而現(xiàn)實(shí)中電池的能量密度往往只有燃料的1%不到。不信請(qǐng)看數(shù)據(jù)。
能量密度比較——汽油:46.4MJ/Kg;鋰 43.1MJ/Kg;鋰電池(不能充電)1.8MJ/Kg;鋰離子電池0.36~0.875MJ/Kg。
其實(shí)汽油與鋰的能量密度還真沒差多大。但從鋰到鋰電池再到鋰離子電池,這中間究竟發(fā)生了什么??
原因很明顯,鋰或者鋰離子電池里面不光是金屬鋰,還有別的水貨。
我查到了這么一個(gè)估算電池里面鋰含量的公式:m=0.3*Ah.用人話說,把電池容量(安時(shí))乘以30%就能算出電池中的鋰含量(克)。
對(duì)于赫赫有名的18650(手機(jī)、筆記本、特斯拉都在用)電池來說,其重量在42g左右,標(biāo)稱容量在2200mAh左右,于是其鋰含量為2200/1000*0.3=0.66g,大概是總重量的1.5%。
原來如此啊!如此一來我們只要提升電池中的鋰含量就能提高能量密度了。
真要這么簡單就好了。我們先來看看鋰電池除了鋰還有啥。
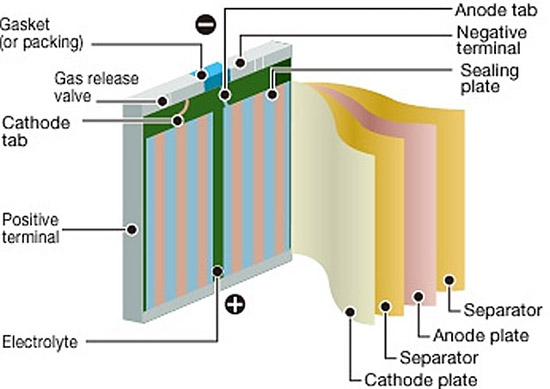
別走啊!!圖看不懂可以聽我歸納嘛。
一般而言電池的四個(gè)部件非常關(guān)鍵:正極(放電為陰極),負(fù)極(放電為陽極),電解質(zhì),膈膜。正負(fù)極是發(fā)生化學(xué)反應(yīng)的地方,重要地位可以理解。但是電解質(zhì)有啥么用處??不做功還很占重量。接著看圖。
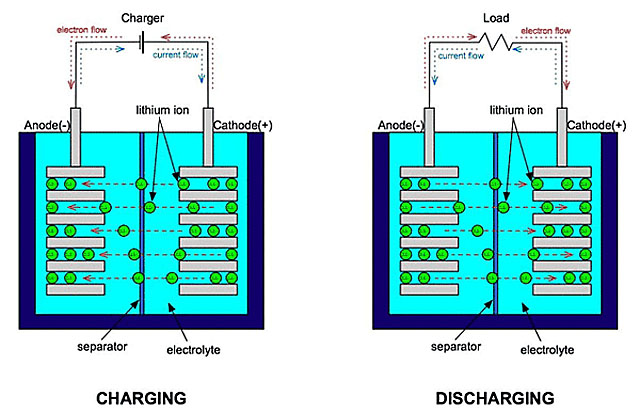
上圖非常好地顯示了電池充放電時(shí)的過程。這里先只說放電:電池內(nèi)部,金屬鋰在負(fù)極失去電子被氧化,成為鋰離子,通過電解質(zhì)向正極轉(zhuǎn)移;正極材料得到電子被還原,被正極過來的鋰離子中和。電解質(zhì)的理想作用,是運(yùn)送且僅運(yùn)送鋰離子。電池外部,電子從負(fù)極通過外界電路轉(zhuǎn)移到正極,中間進(jìn)行做功。理想情況下,電解質(zhì)應(yīng)該是好的鋰離子的載體,但絕不能是好的電子載體。因此在沒有外界電路時(shí),電子無法在電池內(nèi)部從負(fù)極轉(zhuǎn)移到正極;只有存在外界電路時(shí),電子轉(zhuǎn)移才能進(jìn)行。
真暈,你不是說“能量載體們涉及到的具體化學(xué)過程千變?nèi)f化,但總能歸納到一個(gè)氧化還原反應(yīng)”,“氧化還原反應(yīng)的實(shí)質(zhì)是電子從還原劑到氧化劑的轉(zhuǎn)移”,汽油車沒有電解質(zhì)吧?但是汽油燃燒也有電子轉(zhuǎn)移吧,怎么就不能發(fā)電呢?
是的,燃燒必然涉及電子轉(zhuǎn)移,那么燃燒的電子轉(zhuǎn)移與電池的電子轉(zhuǎn)移根本區(qū)別在哪里??
——是否有序。
燃燒的電子轉(zhuǎn)移在微觀范疇上完全無序也不可控。我們完全沒法預(yù)測燃料與氧氣分子會(huì)往哪個(gè)方向運(yùn)動(dòng),下一時(shí)刻的速率如何,我們也不知道燃料上的電子會(huì)向那個(gè)方向轉(zhuǎn)移到哪個(gè)氧氣分子上。10^20-23次方的分子的隨機(jī)運(yùn)動(dòng)與更多的電子的隨機(jī)轉(zhuǎn)移導(dǎo)致的結(jié)果是無序的能量釋放,或者簡單點(diǎn)說,放熱。
電池相比而言就好辦點(diǎn)。盡管我們依舊不知道電池里面的每一個(gè)分子的運(yùn)動(dòng)軌跡,但我們至少可以知道:金屬鋰只會(huì)在負(fù)極材料表面失去電子成為鋰離子;鋰離子會(huì)從負(fù)極出發(fā),最終到達(dá)正極。電子只會(huì)從負(fù)極材料表面出發(fā),向著高電勢的正極運(yùn)動(dòng)。10^20-23次方的電子的協(xié)同運(yùn)動(dòng),在宏觀上我們稱之為,電流。
總結(jié)一下吧,為了放電,為了有序的電子轉(zhuǎn)移,電池們不得不攜帶沒有能量但是必不可少的電解質(zhì)以及各種輔助材料,于是進(jìn)一步降低了自身的能量密度。
這就完了么?沒有。
二、電池的第二大問題:負(fù)極表面材料
如果你能堅(jiān)持每行讀下來一直讀到這里,恭喜,你對(duì)電池的理解已經(jīng)上了一個(gè)層次。
現(xiàn)在回顧上一部分的內(nèi)容。啥么??全忘了??不就一句話么?由于不做功但是必不可少的電解質(zhì)以及其他輔助材料的存在,電池的能量密度被稀釋了。
這些額外重量到底有多少??
電解質(zhì)的重量一般占電池全重15%(出處的鏈接找不到了)。估計(jì)把外殼,外接電極之類的輔助材料都算上,總重應(yīng)該不超過電池總重的50%。
不對(duì)啊,電池雖然摻“水”了,但也不至于水得如此啊。市面上的鋰離子電池們的能量密度也就單質(zhì)鋰的1%左右。這到底又發(fā)生了什么?
喝點(diǎn)鮮橙多,讓我們看看最常見的鈷酸鋰電池(Tesla Roadster)的電化學(xué)反應(yīng)式。
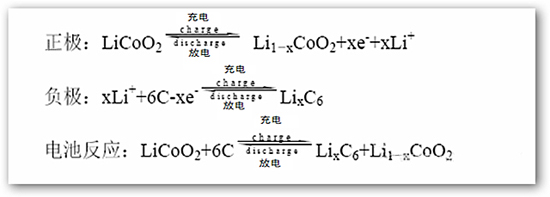
醒醒啊!!化學(xué)不好沒關(guān)系,不要暈倒啊!!都讀到這里了,你也知道答主會(huì)歸納的呀!!
發(fā)生電子轉(zhuǎn)移的其實(shí)只是一部分鋰與鈷,其它的元素均不參與電子轉(zhuǎn)移。
我們計(jì)算一下(計(jì)算過程被Eknower無情地刪掉了),鈷酸鋰電池的電池反應(yīng)的反應(yīng)物總分子量為98+72=170,但只能貢獻(xiàn)半個(gè)電子參與電子轉(zhuǎn)移。因?yàn)橹挥胁糠咒囋訒?huì)發(fā)生反應(yīng)。
假如我們認(rèn)為這兩個(gè)電子的做功是一致的,那么就可以估計(jì)一下這兩種能量載體的能量密度之比了。 電池能量密度:燃料能量密度=(0.5 /170) /(1/6.9) =2.03% 電池完敗。
考慮到電池有一半重量是輔助材料,我剛才沒算進(jìn)去。于是還得打個(gè)折。就剩下1%了。
所以能量密度就成了這樣:鋰 43.1MJ/Kg;鋰離子電池0.36~0.875MJ/Kg 現(xiàn)在你們是否明白,我為啥說:電池背后的化學(xué)限制了電池的能量密度。
接下來我們的問題是:為什么電池的化學(xué)反應(yīng)要那么復(fù)雜,直接降低了電池的能量密度。
這個(gè)問題展開說會(huì)比較復(fù)雜,估計(jì)大部分人沒耐心看完。所以先給個(gè)簡單答案:
為了有序。
好了,沒耐心的人,你們可以走了。下面真的很長,能讀完的都不是一般人。
開始長篇之前再放張圖:
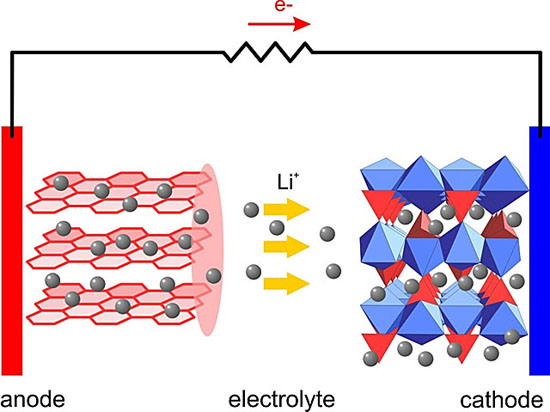
剩下的同學(xué)們,是不是覺得這圖很熟悉?其實(shí)還是鋰電池的示意圖,只是這回陰極陽極的表面結(jié)構(gòu)都顯示出來了。大家有沒有覺得它們都很整齊規(guī)矩啊?
整齊規(guī)矩?fù)Q個(gè)說法,有序。
為什么正極負(fù)極的表面結(jié)構(gòu)都需要有序?因?yàn)橐WC在充電/放電時(shí),氧化還原反應(yīng)只在正極和負(fù)極的表面發(fā)生,這樣才能有電流。
我們先看石墨(C6)所在的負(fù)極。負(fù)極的任務(wù)很簡單,放電時(shí)保證鋰原子(不是離子)都在負(fù)極表面失去電子,充電時(shí)再把它們抓回來就好了。由于充電時(shí)陽極電壓低,帶正電的鋰離子會(huì)自發(fā)向負(fù)極移動(dòng),得到電子回歸為鋰原子。
似乎沒有石墨什么事情啊??
如果是一次性電池,確實(shí)不需要石墨。但如果是可充放電池,陽極表面材料不是石墨也會(huì)是其它物質(zhì)。這是為了防止出現(xiàn)析晶。出現(xiàn)析晶會(huì)導(dǎo)致鋰晶體刺穿隔膜到達(dá)正極,于是電池短路報(bào)廢了。
對(duì)于析晶這一現(xiàn)象,我們可以這么理解:
在充電過程中,我們對(duì)于鋰離子的控制實(shí)際上很弱。我們只能保證鋰離子會(huì)移動(dòng)到負(fù)極表面,但我們無法保證鋰離子會(huì)均勻地分布在負(fù)極表面。因此在沒有外來約束條件下,充電時(shí)鋰晶體會(huì)在負(fù)極表面無序生長,形成枝晶 (dendritic crystal)。
所以一定要有個(gè)約束條件。要挖個(gè)坑讓鋰離子往里面跳。
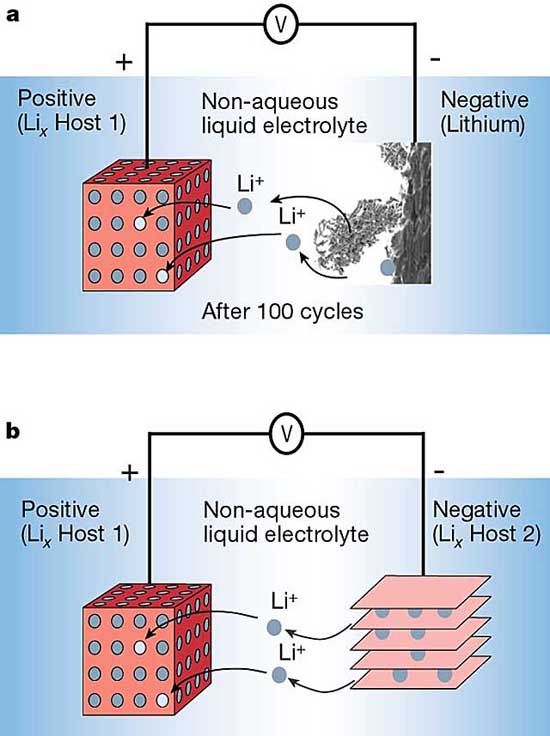
這個(gè)坑的具體表現(xiàn)即為負(fù)極表面的石墨材料。如上圖所示,石墨層之間的空隙夠大,足以容納單個(gè)鋰原子,但也只能容納單個(gè)鋰原子;然后石墨層與鋰原子之間的物理吸附作用可以穩(wěn)住鋰原子,于是鋰原子在沒有外來電壓時(shí)候也能安心待在負(fù)極表面。
如此一來,鋰原子便不會(huì)野蠻生長了。但能量密度也上不去了。
三、電池的第三大問題:正極表面材料
上一部分歸納總結(jié)一下,為了讓鋰原子在每次充電時(shí)能夠均勻有序地分布在負(fù)極表面,負(fù)極表面需要一層固化的結(jié)構(gòu)來約束(有序化,降低熵值)鋰原子的分布。這個(gè)設(shè)計(jì)在很大程度上稀釋了電池的能量密度。
正極實(shí)際上也有同樣的問題,為了讓鋰離子在每次放電時(shí)能夠均勻有序地分布在正極表面,正極表面需要一層固化的結(jié)構(gòu)來約束(有序化,降低熵值)鋰離子的分布。這個(gè)設(shè)計(jì)在很大程度上稀釋了電池的能量密度。
但還不止。
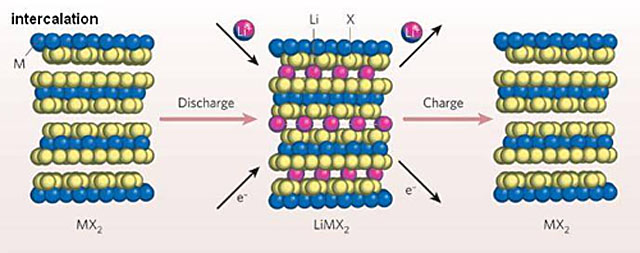
我相信,能看到這里的人,一定有非凡的耐心,你們一定能明白這張圖的含義。
這是電池正極材料充放電時(shí)結(jié)構(gòu)變化的示意圖。這里的M代表金屬原子,X代表氧原子。這張圖的各種原子的大小比例不要當(dāng)真。鋰離子要比另外兩個(gè)都小很多。
我們可以看到,MX2們?cè)谡龢O基底上形成了幾層很規(guī)整(很有序)的結(jié)構(gòu),放電時(shí),電子在正極(正極)聚集,鋰離子向正極移動(dòng),穿插進(jìn)入MX2結(jié)構(gòu)的空隙,從而有序的分布在正極表面。MX2中的金屬離子得到電子被還原,從而起到氧化劑的作用。
然而這張圖實(shí)際上包含了另一個(gè)大問題。
大家有沒有覺得兩邊的結(jié)構(gòu)圖看上去特別的豆腐渣??就像下面這樣。

如果你玩過層層疊這種類型的游戲,估計(jì)會(huì)知道,總有那么幾塊積木,看上去無關(guān)緊要,但只要一動(dòng)。。。。就成下面這樣子了。

這個(gè)結(jié)構(gòu)一旦坍塌,不可能自己恢復(fù)的。
怎么辦?適可而止,見好就收。套在電池正極這方面來說的話,那就是正極表面必須保持一定量的鋰離子來維持結(jié)構(gòu)的完整。這個(gè)一定量,一般是50%。所以,即使是在充滿電的狀態(tài)下,還有近一半的鋰離子停留在正極表面。于是能量密度更低了。
題外話:這也是為啥鋰電池很怕過度充電,一旦過度充電,陰極的鋰離子跑光了,這堆積木就要塌方了。
四、電池的第四大問題:材料選擇上的捉襟見肘
我假設(shè)看到這里的人完全理解了可充放電池設(shè)計(jì)上的種種限制:為了有序的電子轉(zhuǎn)移,為了有序的鋰離子與鋰原子的分布,電池需要電解質(zhì)以及各種輔助材料,需要在陰極陽極表面有規(guī)整的結(jié)構(gòu),而這些都是以能量密度為代價(jià)的。
再回頭想想你最初的那些看法:
1)電池技術(shù)太弱了?這些設(shè)計(jì)多么巧妙,明明是人類智慧之大成。
2)電池技術(shù)大有可為?對(duì)于未來的展望,我們必須有一個(gè)現(xiàn)實(shí)的態(tài)度。電池技術(shù)已經(jīng)發(fā)展了百余年,早就過了爆發(fā)期;支持電池技術(shù)發(fā)展的理論科學(xué)為物理與化學(xué),它們的理論大發(fā)展大突破都是在二戰(zhàn)前就已經(jīng)結(jié)束了。可預(yù)見未來的電池技術(shù),必然是基于現(xiàn)在的電池的發(fā)展。
在民用領(lǐng)域,電池的能量密度是讓人最為頭疼的問題之一,但又是最難解決的問題。過去的電池能量密度之所以能不斷提高,是因?yàn)榭茖W(xué)家一直在找原子量更小的元素來充當(dāng)氧化劑、還原劑以及支持結(jié)構(gòu)。于是我們見證了從鉛酸到鎳鎘、從鎳鎘到鎳氫、從鎳氫到現(xiàn)在的鋰離子的可充放電池發(fā)展歷程,但以后呢?
還原劑方面:我在開頭就說過了,電子轉(zhuǎn)移比例高的元素就那么幾個(gè):氫,碳,硼,鈹,鋰。其中適合作為可充電電池還原劑的只有鋰。氫,碳,只在燃料電池中出現(xiàn)。硼,鈹至今都不是主要的研究方向,我也不知道這是為什么。
氧化劑方面:如果不用過渡金屬,那么選擇就是第二行第三行的主族元素。鹵素顯然不行,那么就剩下氧與硫。現(xiàn)實(shí)是鋰空氣電池(鋰、氧)與鋰硫電池都有很多人研究,但進(jìn)展都不樂觀。為啥?
因?yàn)殡姵氐谋砻娼Y(jié)構(gòu)才是大問題。
現(xiàn)在納米技術(shù)不是進(jìn)展很大么?以后科學(xué)家們肯定能用各種納米線納米管納米球納米碗石墨烯設(shè)計(jì)出精細(xì)有序的表面結(jié)構(gòu)的。那些實(shí)驗(yàn)室們隔三差五的都會(huì)放出幾個(gè)大新聞啊。
這倒也沒錯(cuò),只是很可能會(huì)碰上隱藏boss。
啥??都到這里了你搬出來什么隱藏boss??搞笑啊!!!老子不看了!!!
不看就不看,反正我也不會(huì)告訴你隱藏boss是什么。這個(gè)超出我專業(yè)范疇了。不過有兩個(gè)問題,如果還有人,不妨想一下。
1)石墨一直是鋰電池負(fù)極材料的不二選擇,事實(shí)上如果只考慮能量密度的話,金屬錫更適合作為負(fù)極材料。但到現(xiàn)在為止也就sony 推出過錫電極的電池 (Sony nexelion 14430W1) 為什么會(huì)這樣?
2) 除了鈷酸鋰之外,目前的其它鋰電池正極熱點(diǎn)材料,還有三元化合物L(fēng)i(NiCoMn)O2 、磷酸鐵鋰 (LiFePO4)。 然而由于壓實(shí)密度原因,采用這些材料的電池的容量并不如鈷酸鋰電池。為什么人們還要大力研究?


